А.В.Решетников, А.В.Карменян, О.Ю.Абакумова, Н.П.Неугодова, И.Д.Залевский, С.Е.Гончаров. Оценка биологической и противоопухолевой активности нового фотосенсибилизатора для клинического исследования–Радахлорина,0,35%-го раствора для внутривенного введения.
Untitled Document
В сб. «Использование лазеров для диагностики и лечения заболеваний. Научно-информационный сборник» (приложение к бюллетеню «Лазер-информ»), в печати
А.В.Решетников1, А.В.Карменян2, О.Ю.Абакумова3, Н.П.Неугодова4, И.Д.Залевский1,5,6, С.Е.Гончаров6
1ООО «РАДА-ФАРМА», г.Москва
2НИИ Экспериментальной диагностики и терапии опухолей Российского онкологического научного центра им. Н.Н.Блохина РАМН, г.Москва;
3НИИ биомедицинской химии им. В.Н.Ореховича РАМН, г.Москва;
4Институт стандартизации лекарственных средств, г.Москва;
5ООО «КВАЛИТЕК», г.Москва;
6ООО «МИЛОН ЛАЗЕР», г. Санкт-Петербург;
1. Введение
В настоящее время тетрапиррольные соединения (например, порфирины и производные ряда хлорофилла) вызывают большой интерес как фотосенсибилизаторы (ФС) для применения в терапии злокачественных новообразований. В течение последнего десятилетия сформировалось соответствующее направление в химиотерапии опухолей, именуемое фотодинамической терапией (ФДТ) опухолей, состоящее последовательно из системного или местного введения ФС и лазерного облучения опухоли на длине волны, соответствующей одному из максимумов поглощения ФС (как правило, длинноволновому). Одной из проблем такого подхода является повышение селективности накопления ФС в опухоли [1], так как следствием низкой селективности является невысокая эффективность лечения и повышенная чувствительность кожи к дневному свету.
С целью повышения селективности используются такие приемы, как:
- cтруктурно-функциональный подход к синтезу ФС с заданными свойствами [2,3];
- ковалентное присоединение ФС к моноклональным антителам против опухолеассоциированных антигенов [4,5];
- образование нековалентных комплексов ФС с липопротеинами [6];
- использование ФС в виде липосомных препаратов [7,8];
- доставка ФС с помощью векторов, способных избирательно связываться с клеточными органеллами раковых клеток [8,9].
При синтезе тетрапирролов наблюдается тенденция к созданию соединений с заданными свойствами на основании структурно-функциональных свойств [10]. Это применимо, в частности, к конструированию и получению новых ФС для ФДТ, характеризующихся повышенной туморотропностью и обладающих высокой цитофототоксичностью по отношению к опухолевым клеткам после облучения [11-14]. В результате анализа большого объема экспериментальных и клинических материалов были сформулированы основные требования к оптимальному ФС, включающие биологические (токсические и фармакокинетические), фотофизические и химико-технологические критерии [1]. Прежде всего это:
- доступность получения или синтеза, однородный химический состав;
- хорошая растворимость в воде или разрешенных для внутривенного введения жидкостях и кровезаменителях;
- стабильность при действии света и хранении;
- оптимум между величинами квантового выхода флюоресценции (способность ФС флюоресцировать обусловливает его диагностические возможности и облегчает контроль накопления и выведения его из тканей) и квантового выхода интерконверсии (определяет способность ФС к генерации синглетного кислорода);
- высокая селективность накопления в тканях злокачественных новообразований;
- быстрое выведение фотосенсибилизатора из кожи и эпителиальной ткани;
- низкая темновая и световая токсичность в терапевтических дозах;
- сильное поглощение в спектральном диапазоне, где биологические ткани имеют наибольшее пропускание (красный и ближний ИК диапазоны);
- высокий квантовый выход образования синглетного кислорода в условиях in vivo.
Основное ограничение метода ФДТ - глубина действия лазерного излучения. Используемые в клинике препараты имеют спектр фотодинамического воздействия с максимумами в области 620 - 690 нм. Проницаемость биологических тканей в этом диапазоне незначительна и составляет несколько миллиметров. Известно, что максимальная проницаемость тканей находится в дальней красной и ближней ИК области 750 - 1500 нм и соответствует диапазону генерации эффективных, надежно работающих и доступных лазеров. Поэтому актуально создание и внедрение ФС, обеспечивающих эффективную генерацию синглетного кислорода в этой области спектра и увеличивающих возможности ФДТ. В настоящее время проводится направленный поиск таких ФС среди производных хлоринов, бактериохлоринов, пурпуринов, бензопорфиринов, тексафиринов, этиопурпуринов, нафтало- и фталоцианинов [15]. При этом особый интерес представляют ФС, обладающие способностью не только быстро накапливаться в опухолях, но и с высокой скоростью распадаться. Со временем, как это принято в химиотерапии опухолей, будет создан банк ФД препаратов адресного спектра применения, адаптированных к определенным нозологическим и гистологическим формам рака.
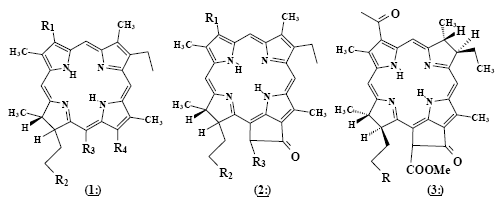
Впервые водорастворимые производные хлорофилла предложил использовать для медицинских целей Э.Снайдер (США) в 1942 г [16]. При пероральном или внутривенном применении хлориновых смесей, в основном содержащих хлорин р6 1: (R1=Vi, R2=COOH, R3 =COOH, R4=COOH) (Рис.1а), были отмечены низкая токсичность, гипотензивное, антисклеротическое, спазмолитическое, обезболивающее, противоревматоидное действие. При пероральном применении в дозах 1 г в день в течение 30 дней улучшались показатели биохимии крови, в частности, в 1,5-2 раза снижался уровень холестерина в крови. Это послужило показанием к использованию водорастворимых хлоринов для профилактики и лечения сердечно-сосудистых заболеваний, атеросклероза, ревматоидного артрита [17].
Первое упоминание об использовании производных хлоринового ряда для ФДТ касается производных феофорбида а 2: (R1=Vi, R2=COOH, R3=COOMe) (Рис.1б), которые относятся к хлоринам. Некоторые из них были запатентованы в качестве потенциальных ФС для ФДТ в 1984 г . в Японии (И.Саката и сотр.) [18].
В научной литературе об использовании производных хлоринового ряда для ФДТ было заявлено в 1986 г . [19], когда группа авторов из США (Дж.Боммер, Ж.Швейда и Б.Бирнхем), исходя из оценки перспективности свойств хлорина е61: (R1=Vi, R2=COOH, R3=CH2COOH, R4=COOH), сообщила о результататах своего поиска ФС, удовлетворяющего важнейшим требованиям ФДТ, а именно хорошей туморотропности и интенсивному поглощению в длинноволновой красной области спектра. Выбор был остановлен на моно-L-аспартил хлорине е6(МАСЕ) 1: (R1=Vi, R2=COAsp, R2=CH2COOH, R4=COOH), который в настоящий момент находится на завершающей стадии клинических испытаний в Японии. Одновременно в США Дж.Боммером и Б.Бирнхемом для японской компании Nippon Petrochemicals Company был заявлен для патентования ряд функционализированных производных хлорина е6 и бактериофеофорбида а 3: ( R=COOH) (Рис.1в) как ФС для ФДТ [20].
Рис.1. Структурные формулы типичных ФС хлоринового ряда.
2. Химические свойства «Радахлорина, 0,35%-ного раствора для внутривенного введения» («Радахлорина»).
Нами проводятся систематические исследования тетрапиррольных макроциклов хлоринового ряда (производных хлорофилла а ) с целью выявления структурно-функциональных закономерностей накопления фотосенсибилизаторов в опухоли, повышения терапевтического отношения, создания на их основе лекарственных субстанций и форм, их всестороннего доклинического изучения и последующего внедрения лучших соединений в клиническую практику ФДТ [ 3,10,21].
Одним из результатов данного поиска является «Радахлорин, 0,35%-ный раствор для внутривенного введения» [22].
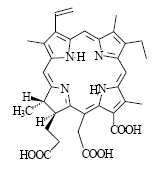
«Радахлорин» содержит композицию из трех циклических тетрапирролов хлориновой природы (с гидрированным кольцом D), основной из которых (80-90%) - хлорин е61: (R 1 =Vi, R2=COOH, R3=CH2COOH, R4=COOH). В дополнение к нему имеется ФС, обладающий способностью с высокой избирательностью накапливаться в неопластических образованиях и абсцессах, а также возможен примесный компонент (<5%) (Рис.2).
Рис. 2. Структурная формула одного из двух главных компонентов “Радахлорина” –хлорина е6.
3. Фотофизические свойства «Радахлорина, 0,35%-ного раствора для внутривенного введения».
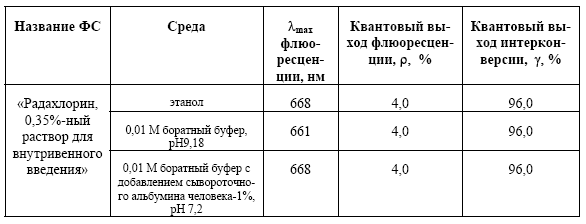
ФС обладают способностью поглощать свет в видимой области, результатом чего является их фотоактивация и последующая релаксация возбужденного состояния с переносом энергии на растворенный в тканях молекулярный кислород и органические субстраты. Последнее приводит к окислительным и свободно-радикальным процессам в биологических тканях и их повреждению и последующему разрушению (некрозу). Наиболее предпочтительной для ФДТ полосой возбуждения является самая длинноволновая полоса поглощения конкретного ФС (Табл.1, Рис.3), т.к. с ростом длины волны растет проникающая способность света в биологические ткани.
В первую очередь для соединений с предполагаемой биологической активностью нами исследуются их фотофизические свойства в различных средах.
Табл. 1. Положения максимумов поглощения и величины молекулярной экстинкции поглощения для длинноволновой полосы «Радахлорина, 0,35%-ного раствора для внутривенного введения» в различных средах.

Табл. 2. Спектрально-люминесцентные свойства «Радахлорина, 0,35%-ного раствора для внутривенного введения» в различных средах.
«Радахлорин, 0,35%-ный раствор для внутривенного введения» способен разрушать биологические объекты после возбуждения светом с длиной волны 654-670 нм, что соответствует эффективной глубине проникновения света в ткани до 7 мм .
Высокая степень фототоксичности «Радахлорина» связана с высоким квантовым выходом интерконверсии (Табл.2), что коррелирует с высоким квантовым выходом синглетного кислорода – одного из основных токсических агентов, высвобождаемых под действием света при ФДТ [23]. Сохраняющаяся при этом способность препарата флюоресцировать оставляет возможность для фотодинамической диагностики очагов неопластического изменения тканей. Для этого препарат возбуждают в любую из полос – 406, 506, 536, 608 или 662 нм и регистрируют интенсивную флюоресценцию при 668 нм.
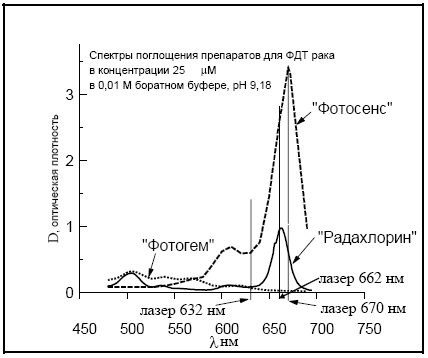
Рис. 3. Спектры поглощения препарата “Радахлорин” в сравнении с препаратами “Фотосенс” и “Фотогем”.
В опытах по изучению фотодинамической активности РХ использовался полупроводниковый лазерный диодный модуль для фотодинамической терапии «ЛАХТА-МИЛОН» , разработанный и запатентованный ООО «МИЛОН ЛАЗЕР» совместно с ООО «РАДА-ФАРМА» [24] и производимый компанией «Квалитек», Москва.
Аппарат «ЛАХТА-МИЛОН» - лазерный прибор нового поколения - является результатом развития лазерной медицинской аппаратуры в области повышения надежности, миниатюризации, расширения пользовательского интерфейса и увеличения количества используемых длин волн.
Прибор предназначен для использования в фотодинамической терапии, лазерной гипертермии, лазерной хирургии.
Лазер может осуществлять следующие виды воздействия на ткань: фoтохимическое (с применением фотосенсибилизатора), фотохимическое (без применения фотосенсибилизатора – длина волны 1260 нм), нагрев (термотерапия и гипертермия), вапоризация, коагуляция, иссечение тканей (контактное и бесконтактное).
ОСНОВНЫЕ СВОЙСТВА:
• тип излучателя – матрица дискретных лазерных диодов
• широкий ассортимент возможных длин волн:
635,662,670,690,798,808,920,960,975,1060,1260,1300,1470,1530,1750 нм
• один или два независимых лазерных канала
• полная совместимость со стандартными световодами и лазерным инструментом
• диаметр световедущей жилы 200мкм и более (стандартно) и 100мкм (опционно)
• наличие прицельного лазера в каждом канале
• импульсный и непрерывный режим
• современное микропроцессорное управление
• большой графичесий дисплей
• цифровая индикация и регулировка мощности, энергии, длительности импульса и
интервала, времени экспозиции, яркости прицела
• счетчик импульсов
• максимальная мощность от 1 Вт до 20 Вт в зависимости от длины волны
• малые габариты (170х200х280 мм) и вес ( 6,5 кг )
4. Результаты биологических испытаний.
4.1. Исследование цитотоксичности и цитофототоксичности in vitro.
При дальнейшем определении пригодности соединения для использования в качестве эффективного ФС для ФДТ измеряется его коэффициент распределения в системе октанол/буферный раствор, а также оцениваются цитотоксичность и цитофототоксичность в опытах in vitro (Табл.3).
Исследование цитотоксической («темновой») и цитофототоксической активности проводилось в культурах клеток феохромоцитомы крысы (РС12), нвриномы гассерова узла крысы ( NGUK 1) и гепатомы крысы ( Hep 27) при использовании 3-х независимых методов оценки - МТТ-теста, окрашивания клеточного монослоя кристалл-виолетом и по включению в ДНК С13 -тимидина. Препаратом сравнения служил препарат “Фотосенс” (ГНЦ РФ НИОПИК).
Экспозиционная доза облучения лазером «ЛАХТА-МИЛОН» составляла 50 Дж/см2.
Согласно литературным данным [2,25], наибольшую эффективность в качестве ФС для ФДТ проявляют амфифильные соединения, для которых коэффициент распределения в системе 1-октанол/фосфатный буфер с pH 7.4 (Kp) больше 1. Для “Радахлорина” этот показатель составляет 1,4 (Табл.2), что является признаком перспективности дальнейшего изучения свойств этого соединения.
Представленные в Табл.3 полученные при определении цитотоксичности данные позволяют предположить, что в отсутствии облучения лазером для “Радахлорина” в небольшой степени, а “Фотосенса” – в значительной – характерно проявление цитотоксической активности.
При облучении лазером клеточной культуры, инкубированной с ФС, наступает гибель клеток. Цитофототоксичность соединений принято оценивать по величине концентрации в микромолях ( μM ) препарата, при которой погибает 50% всех клеток (ЕС50). В приведенном здесь примере ФС по эффективности распределяются следующим образом: “Радахлорин”≥“Фотосенс”. Что касается абсолютных значений, то ФС с цитофототоксичностью менее 20 μM считаются эффективными [2].
Табл. 3. Коэффициент липофильности и активность in vitro в культуре клеток РС 12 [26].

4.2.Острая токсичность и пирогенность in vivo.
Обнадеживающие результаты по цитофототоксичности способствовали дальнейшему изучению токсичности и пирогенности «Радахлорина» в опытах in vivo . Исследование токсичности проводили на мышах, а пирогенности – на кроликах (Табл.4).
«Радахлорин, 0,35%-ный раствор для внутривенного введения» один раз вводили внутривенно.
При изучении острой токсичности проводили наблюдение за животными, оценивали сроки гибели, число павших животных, клиническую картину интоксикации, поведенческие реакции и макроскопическое состояние внутренних органов павших животных. LD50 расчитывали с помощью метода пробит-анализа. Полученные результаты позволяют отнести «Радахлорин» к классу соединений “малотоксичные”, для которых LD50 находится в диапазоне 101-1000 мг/кг.
При испытании на пирогенность установлено, что в тест-дозе 0,7 мг ФС на кг массы тела кролика “Радахлорин” апирогенен. Эта тест-доза соответствует общепринятым дозам для определения пирогенности - 1/20 от терапевтической дозы для человека.
Табл.4. Острая токсичность и пирогенность «Радахлорина» in vivo.

4.3. Фармакокинетика.
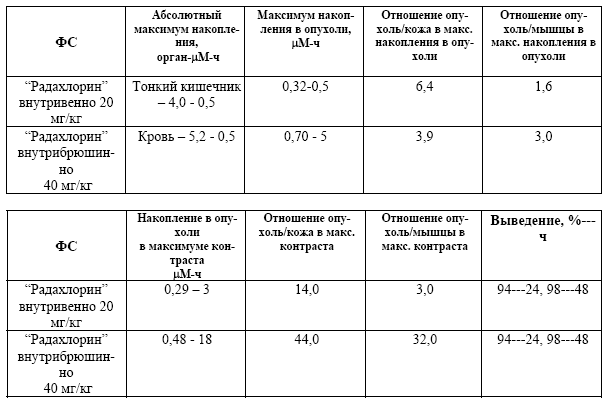
При введении препарата «Радахлорин, 0,35%-ный раствор для внутривенного введения» внутрибрюшинно мышам с перевитой в мышцу задней ноги эмбриокарциномой Т36 в дозе 40 мг/кг наблюдаются следующие закономерности в его распределении. После введения препарат попадает в печень, а затем в кровь, после чего он перераспределяется в органы и ткани животных (Табл.5). При внутривенном введении препарата были получены аналогичные закономерности биораспределения.
Максимум накопления субстанции в опухоли (0,70 μM) достигается через 5 часов после внутрибрюшинного введения в дозе 40 мг/кг и длительное сохраненяется (18-24 часа). Опухолевая концентрация субстанции через 18 ч после введения препарата составляет 0,48 μM, что всего в 1,5 раза меньше, чем в абсолютном максимуме накопления, при высокой селективности накопления. Отношение опухоль/мышечная ткань составляет через 18 часов - 32, а опухоль/кожа – 44.
После внутривенного введения препарата в дозе 20 мг/кг максимум накопления в опухоли регистрируется через 0,5 часа (0,32 μM) и также длительно сохраняется (до 5 часов). Максимальная контрастность накопления при внутривенном введении проявляется через 3 часа и составляет для опухоли/мышечной ткани - 3, а опухоли/кожи – 4.
Препарат выводится из организма через сутки на 98%.
5. Фотодинамическая терапия.
Изучение фотодинамической активности препарата «Радахлорин, 0,35%-ный раствор для внутривенного введения» было проведено на мышах линии Balb/c с перевитой в мышцу задней лапы эмбриокарциномой Т36. Вес мышей — 20-21 грамма. Процедуру облучения проводили диодным лазером «ЛАХТА-МИЛОН» через 2 недели после перевивки опухоли. Перед началом облучения была проведена предварительная депиляция кожи в области облучения.
Соединение вводили внутрибрюшинно в дозе 40 мг/кг веса, что соответствует достаточной терапевтической дозе. Для проведения процедуры облучения мыши вводились в эфирный наркоз. Вес опухолей в контрольной и опытной группе в момент эксперимента варьировал от 0.9 до 1 грамма. Облучение проводили через 5-6 часов после введения ФС. Каждое животное, за исключением контрольных, подвергалось однократной процедуре облучения, затем проводились наблюдения в течение месяца после проведённого воздействия, регистрируя площадь некроза опухолей и общее физиологическое состояние.
Средняя плотность экспозиционной дозы облучения составляла 150 или 300 Дж/см2.
Наилучшие результаты в виде полного некроза опухоли, образования корочки через 1 неделю после ФДТ и ее отпадания через 1,5 мес после ФДТ наблюдались в группе, получившей световую дозу 300 Дж/см2.
Полученные результаты позволяют констатировать факт наличия выраженной фотодинамической активности данного соединения в экспериментах in vivo на мышах.
Табл. 5. Главные фармакокинетические показатели.
Выводы.
Хлориновые тетрапиррольные фотосенсибилизаторы обладают интенсивной полосой поглощения в длинноволновой области, оптимальным соотношением флюоресценция/интерконверсия и проявляют на порядок большую световую токсичность, чем большинство ФС, при отсутствии темновой токсичности. Общие токсические свойства при введении хлориновых ФС в организм оказываются лучше, чем у порфириновых олигомеров или сульфированных фталоцианинов, а скорости выведения препаратов из организма не сравнимы: “Фотосенс” и “Фотогем” сохраняются в организме на период более трёх месяцев против 2-х суток у водорастворимых хлориновых ФС.
Осуществляемый нами структурно-функциональный поиск позволяет получать фотосенсибилизаторы с хорошими фотофизическими, биологическими характеристиками и высокой специфической активностью, что создает возможность для получения ФС, наделенного комплексом оптимальных для ФДТ свойств.
Препарат «Радахлорин, 0,35%-ный раствор для внутривенного введения» обладает рядом преимуществ по отношению к другим препаратам для ФДТ:
- достижение высокого (0,70 μM) максимума накопления в опухоли через 5 часов после внутрибрюшинного введения в дозе 40 мг/кг и длительное его сохранение (18-24 часа). Опухолевая концентрация через 18 ч после введения составляет 0,48 μM, что всего в 1,5 раза меньше, чем в абсолютном максимуме накопления, при исключительно высокой селективности накопления. Отношение опухоль/мышечная ткань через 18 часов составляет 32, а опухоль/кожа – 44;
- достижение высокого (0,32 μM) максимума накопления в опухоли через 0,5 часа после внутривенного введения в дозе 20 мг/кг и длительное его сохранение (до 5 часов). Максимальная контрастность накопления при внутривенном введении проявляется через 3 часа и составляет для опухоли/мышечной ткани 3, а опухоли/кожи – 4;
- быстрое выведение препарата из организма: через сутки – 98%;
- высокая фотодинамическая активность препарата in vivo при низкой цитотоксичности.
В результате проведения ФДТ с «Радахлорином, 0,35%-ным раствором для внутривенного введения» получено увеличение средней продолжительности жизни в опытной группе животных, облученной лазерным излучением 300 Дж/см2 почти в 2 раза при выраженной деструкции опухолей. Этот результат был во многом достигнут благодаря рабочим характеристикам лазера «ЛАХТА-МИЛОН».
Свойства «Радахлорина» позволяют радикально изменить саму технологию ФДТ в онкологической клинике, поскольку можно исключить этап продолжительного стационарного лечения, необходимый при использовании “Фотофрина-II”, «Фотогема» или «Фотосенса», заменив его однодневным стационаром или даже амбулаторным лечением.
Оптимальным временем для облучения опухолей лазерным излучением в клинике можно считать 3-часовую точку (при внутривенном введении).
Лекарственная субстанция «Жидкий экстракт хлоринов, 7%» разрешена для промышленного выпуска и медицинского применения [27]. Две лекарственные формы - «Радахлорин, 0,35%-ный раствор для внутривенного введения» и «Радахлорин, 0,1%-ный гель для наружного применения» уже прошли серию клинических испытаний в онкологии [28].
Список использованной литературы.
- Иванов А.В. // Медицинская физика. 1996 . Т . 3. С . 55-60.
- Boyle R.W., Dolphin D. // Photochem. Photobiol.- 1996. - V.64. - N3. - p.469-485.
- А . В . Решетников , А . В . Иванов , О . Ю . Абакумова , А . Т . Градюшко , И . Д . Залевский , А . В . Карменян , В . П . Лаптев , Н . П . Неугодова . // В сб . «Использование лазеров для диагностики и лечения заболеваний. Научно-информационный сборник» (приложение к бюллетеню «Лазер-информ»), 2001 , вып. 3, 34-40.
- Yarmush M.L., Thorpe W.P., Strong L., Rakestraw S., Toner M., Tompkins R. // Crit. Rev. Therap. Drug Carr. Syst. 1993 . V. 10. N 3. Р . 197-252.
- Klyashchitsky B.A., Nechaeva I.S., Ponomarev G.V. // J. of Controlled Release. 1994 . V. 29. Р . 1-16.
- Dagan A., Gatt S., Cerbu-Karabat S., Maziere J.-K., Maziere C., Santus R., Engelhardt E.L., Yeh K.A., Stobbe C.C., Fenning M.C., Chapman J.D. // Int. J. Cancer. 1995 . V. 63. Р . 831-839.
- Yemul S., Berger C., Estabrook A., Suarez S., Edelson R., Bayley H. // Pros. Natl. Acad. Sc. USA. 1987 . V. 84. Р . 246.
- Bergstrom L.C., Vucenik I. , Hagen I.K., Chernomorsky S.A., Poretz R.D. // J. Photochem. Photobiol. B-Biol. 1994 . V. 24. N 1. Р . 17-23.
- Akhlynina T.V., Jans D.A., Rozenkranz A.A., Statsyuk N.V., Balashova I.Y., Toth G., Pavo I., Rubin A.B., Sobolev A.S. // J. Biol. Chem. 1997 . V. 272. N 33. Р. 20328-20331.
- Иванов А.В., Решетников А.В., Дмитриев А.А., Градюшко А.Т., Швец В.И., Пономарев Г.В. // Материалы второго съезда фотобиологов России . Пущино . 8-12 июня 1998 . С . 362-364.
- Pandey R.K., Shiau F.-Y., Sumlin A.B., Dougherty T.J., Smith K.M . // Bioorg. and Med. Chem. Lett. - 1992 . - Vol.2/5. - P.491-496.
- Pandey R.K., Shiau F.-Y., Smith N.W., Dougherty T.J., Smith K.M. // Tetrahedron . - 1992 . - Vol.48. - N36. - P.7591-7600.
- Jiang X., Pandey R.K., Smith K.M. // Tetrahedron Lett .- 1995 . - Vol.36. - N3. - P.365-368.
- Jiang X., Pandey R.K., Smith K.M. // J. Chem. Soc., Perkin Trans. 1. - 1996 . - P .1607-1615.
- Решетников А.В., Швец В.И., Пономарев Г.В. // в кн. Успехи химии порфиринов. - СПб: НИИ Химии СПбГУ. - 1999 . - Т. 2. - Гл.4. - С. 70-114.
- Pat. 2,274,101 (02/ 1942 ) USA / E.G.Snyder. Preparation of chlorin e.
- Pat. 3,102,891 (09/ 1963 ) USA / E.A.Allen. New porphyrinic and chlorophyllic compositions and process therefor.
- Pat. 4,709,022 (11/ 1987 ) USA / Sakata I. , Nakajima S., et.al. Pheophorbide Derivatives and Alkaline Salts Thereof. // C.A. - 1985 . - V.103. - N15. - 123271s.
- Bommer J.C., Sveida Z.J., Burnham B.F. Further studies on the relationship between tetrapyrrole structure and usefulness as photosensitizers. // Proc. 1st Int. Conf. Clinical Applications of Photosensitization for Diagnosis and Treatment. - 1986 . - p.129.
- Pat. 4,656,186 (04/ 1987 ) USA / Bommer J.C., Burnham B.F. Tetrapyrrol Therapeutic Agents. // C.A. - 1987 . - V.106. - N11. - 85048b.
- Ivanov A.V., Reshetnickov A.V., Shvets V.I., Ponomarev G.V. // Abstracts of 7th International Conference “Laser Applications in Life Sciences”. - Bratislava , Slovak Republic . - 24-28 August, 1998 .
- Решетников А.В., Залевский И.Д., Кемов Ю.В. и соавт. Фотосенсибилизатор и способ его получения . // Патент РФ №2183956. Положительное решение от 21 декабря 2001 г . по заявке № 2001108397 от 30 марта 2001 г .
- A.T.Gradyushko, A.N.Sevchenko, K.N.Solovyov and M.P.Tsvirko. // Photochem. Photobiol., 1970 , 11, 387-400.
- Регистрационное удостоверение №29/01050603/5828-03 от 19.12.2003 на изделие медицинской техники «Аппарат лазерный хирургический фотодинамического и гипертермического режимов воздействия программируемый «ЛАХТА-МИЛОН».
- Решетников А.В., Жигальцев И.В., Коломейчук С.Н., Каплун А.П., Швец В.И., Жукова О.С., Карменян А.В., Иванов А.В., Пономарев Г.В. // Биоорганическая химия. - 1999 . - №10. – c .782-790.
- A.V.Reshetnickov, S. Spaniol, N.P.Neugodova, G.A.Sapozhnikova, O.Yu.Abakumova, T.A.Tsvetkova, I.D.Zalevsky, S.E.Goncharov, A.V.Karmenyan, G.V.Ponomarev. // Abstracts of EBiOS 2000: EOS/SPIE/ELA European Biomedical Optics Week. – Amsterdam , 4-8 August 2000 . – p.43 (full paper submitted).
- Рег. номер Р №001580/01-2002 от 26.07.2002
- «Радахлорин» ® , раствор для внутривенного введения, 0,35% 10 мл. Разрешения на проведение клинических испытаний МЗ РФ № 120 от 04.07.02 и №221 от 18.08.03. Успешно прошел первую (июль 2002 – март 2003) и вторую (август - декабрь 2003) фазы клинических исследований по протоколу лечения базально-клеточного рака кожи. «Радахлорин» ® , гель для наружного применения, 0,1% 25 г . Разрешения на проведение клинических испытаний МЗ РФ № 120 от 04.07.02 и №220 от 18.08.03. Успешно прошел первую (июль 2002 – декабрь 2003) и вторую (август - декабрь 2003) фазы клинических исследований по протоколу лечения базально-клеточного рака кожи. Оба препарата рекомендованы Фармакологическим комитетом Минздравсоцразвития РФ (протокол №10 от 09.06.2005) к широкому медицинскому применению для лечения рака кожи.
|
|






